Regla del Octeto de Lewis YouTube

Esta teoría fue enunciada en 1917 por el físico químico estadounidense Gilbert N. Lewis (1875-1946) y explica que los átomos de los distintos elementos suelen mantener siempre una configuración electrónica estable mediante la ubicación de ocho electrones en sus últimos niveles de energía. La regla del octeto establece que los iones de.
REGLA DEL OCTETO. ESTRUCTURA DE LEWIS ( 1 ejemplo ) YouTube

Regla del Octeto. La regla del octeto establece que los átomos de los elementos se enlazan unos a otros en el intento de completar su capa de valencia (ultima capa de la electrosfera). La denominación "regla del octeto" surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, o sea, el átomo queda.
ESTRUCTURA DE LEWIS 1 ( Regla del Octeto)*VIDEO CORTO* YouTube
Regla del octeto. La teoría del octeto, enunciada en 1916 1 por el fisicoquímico Gilbert Newton Lewis, 2 3 dice que los iones de los elementos del sistema periódico tienen la tendencia a completar sus últimos niveles de energía con una cantidad de 8 electrones, de tal forma que adquieren una configuración muy estable.
PPT REGLA DEL OCTETO PowerPoint Presentation, free download ID4828164

Definición y concepto de la regla del octeto. El concepto de la regla del octeto proviene de la observación de los compuestos de coordinación de finales del siglo XIX y principio del XX.. En 1904, Richard Abegg estudió estos compuestos y formuló la conocida como regla de Abegg, que sostenía que la diferencia entre la valencia positiva máxima y la negativa mínima a menudo era 8, y.
Ejemplos de la regla del octeto Diario Nacional 2023

El óxido resultante consiste en iones aluminio, Al 3 +, e iones óxido, O 2—, en la proporción de 2:3. La fórmula es Al 2 O 3. 6.10: La regla del octeto. Un método conveniente para hacer esto es considerar el compuesto como formado a partir de sus átomos y usar diagramas de Lewis. Entonces se puede aplicar la regla del octeto.
Enlaces Químicos estructura de lewis y regla del octeto YouTube

9.2: Lewis Symbols and the Octet Rule. Chemical bonds are complex interactions between two or more atoms or ions, which reduce the potential energy of the molecule. Gilbert N. Lewis developed a model called the Lewis model that simplified the depiction of chemical bond formation and provided straightforward explanations for the chemical bonds.
PPT REGLA DEL OCTETO PowerPoint Presentation, free download ID6649002

Debido a esto, el boro en BF 3 es un potente aceptor de electrones y forma complejos fuertes con electrones de otros compuestos. En el Capítulo 8 veremos que esta propiedad se llama acidez de Lewis y BF 3 es un ácido de Lewis muy potente. 3.8: Excepciones a la Regla del Octeto CC BY-SA 4.0 Paul R. Young ChemistryOnline.com source content.
PPT Estructura de LewisIntrod PowerPoint Presentation, free download ID4837374

Gilbert N. Lewis postuló en 1916 la regla del octeto, por la que se establece que la tendencia de los iones de los elementos es completar sus últimos niveles de energía con una cantidad de 8 electrones. Lewis enunció la regla del octeto al observar la manera en que se combinan entre sí los elementos. Así, advirtió que todos intentan.
Notación de Lewis y Regla del Octeto YouTube

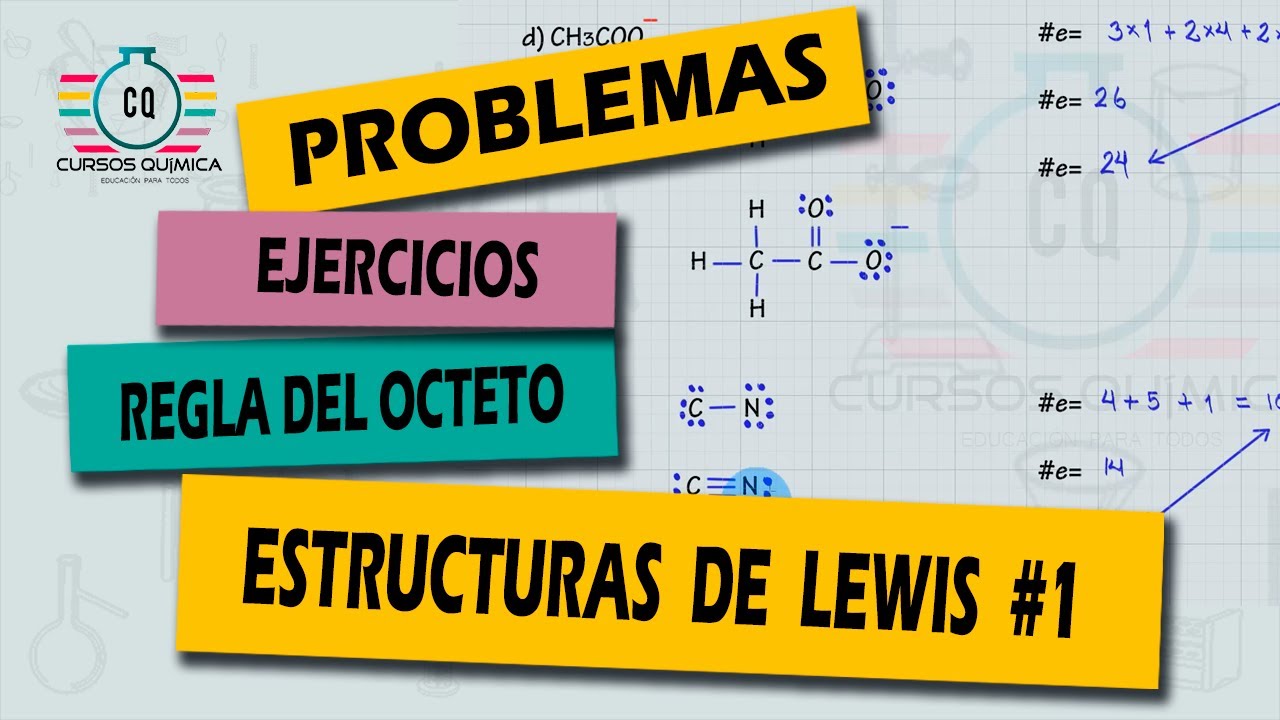
Excepciones a la regla del Octeto. El hidrógeno tiene un sólo orbital en su capa de valencia la cual puede aceptar como máximo dos electrones, junto con el berilio que se completa con una cantidad de cuatro electrones y el boro que requiere de seis electrones para llevar a cabo esta función, de modo en que se elude a la normativa que.
La explicación de la regla del octeto en química Ciencias

La regla del octeto es una regla de la química inorgánica que establece que los átomos individuales en una molécula o ion se comportan de manera óptima cuando tienen 8 electrones en su capa de valencia. Esta regla se aplica a la mayoría de los elementos del grupo principal, que son los elementos del 1 al 8 en la tabla periódica.
Regla del Octeto
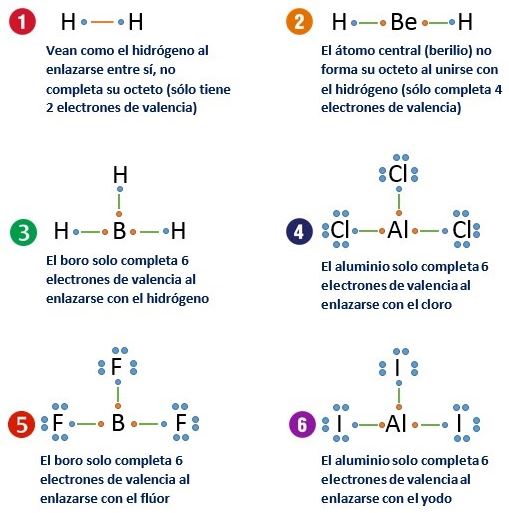
La regla de octeto o regla del octeto es un postulado que se emplea en el contexto de la química. Se trata de la tendencia que evidencian los átomos de completar su nivel energético con ocho electrones para alcanzar estabilidad. La regla de octeto fue postulada por Gilbert Newton Lewis. Navega por el índice de temas del artículo.
Ejemplos De La Regla Del Octeto De Lewis Nuevo Ejemplo

6.14: Las moléculas covalentes y la regla del octeto. La idea de que una molécula podría ser mantenida unida por un par compartido de electrones fue sugerida por primera vez por Lewis en 1916. Aunque Lewis nunca ganó el premio Nobel por esta o sus muchas otras teorías, el par compartido de electrones es sin embargo una de las.
Regla del octeto qué es

La regla del octeto. En 1904, Richard Abegg formuló lo que ahora se conoce como regla de Abegg, que establece que la diferencia entre las valencias máximas positivas y negativas de un elemento es frecuentemente de ocho.Esta regla fue utilizada más tarde en 1916 cuando Gilbert N. Lewis formuló la "regla del octeto" en su teoría de átomos cúbicos.
Que Elementos Cumplen Con La Regla Del Octeto wenda
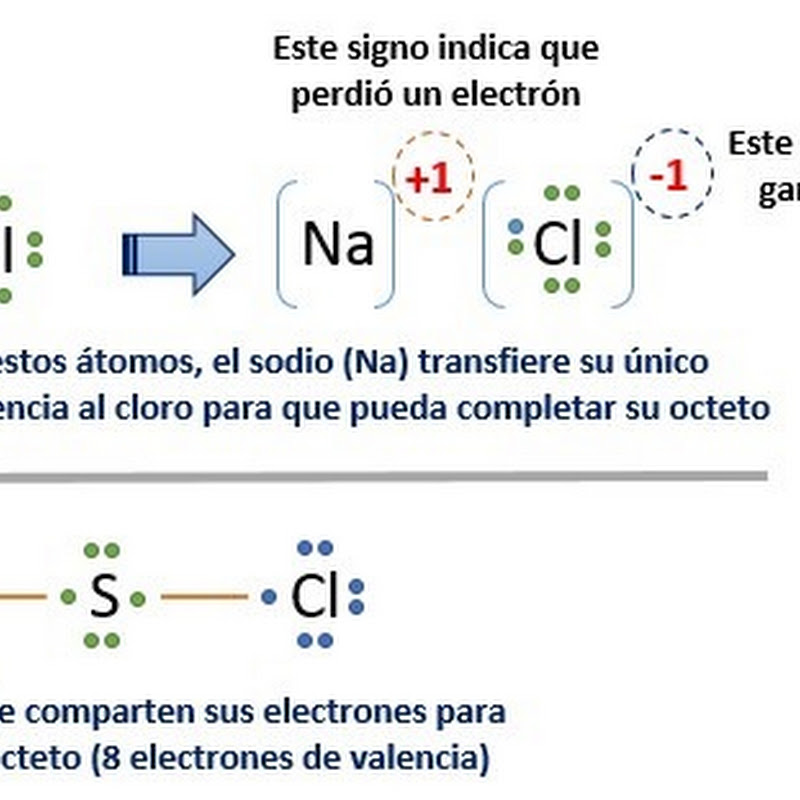
Ejemplos del cumplimiento de la regla del octeto. La regla del octeto se aplica principalmente a los elementos representativos, es decir, a los de los bloques s y p de la tabla periódica. Esta regla se aplica de forma consistente a los compuestos que contienen carbono, nitrógeno, oxígeno y halógenos, y con algunas excepciones a los demás.
Excepciones a la regla del octeto en un diagrama de Lewis Khan Academy en Español YouTube

La regla del octeto establece que los átomos tienden a formar compuestos de manera que les dan ocho electrones de valencia, y así la configuración electrónica de un gas noble. Una excepción a un octeto de electrones es en el caso del primer gas noble, el helio, que sólo tiene dos electrones de valencia. Esto afecta principalmente al.
Explica La Regla Del Octeto Ripo

Ejemplos de la regla del octeto. En el agua, el oxígeno completa su último nivel de energía con 8 electrones y el hidrógeno con 2. Pensemos en una molécula de CO2 cuyos átomos presentan valencias de 4 (carbono) y 2 (oxígeno), unidos por enlaces químicos dobles. (Es importante aclarar que la valencia son los electrones que debe ceder o.
.